واکسن (Vaccine) سوسپانسیونی از بخشهایی از میکروارگانیسمها یا پاتوژن های ضعیف یا کشته شده است و در برخی مواقع از سموم یا توکسینها،آنتی بادی ها یا لنفوسیتها در ساخت واکسن استفاده میشود. محتویات واکسن از بدن در برابر انواع عوامل بیماریزا مانند ویروس ها و باکتری ها محافظت میکند.
واکسنها موجب ایجاد «ایمنی فعال» (Active Immunity) در برابر عوامل بیماریزا در بدن میشوند، در واقع آنها این کار را به وسیله تحریکسیستم ایمنی بدن برای مبارزه با عوامل بیماریزا و از بین بردن آنها انجام میدهد.
تصویر1. تزریق واکسن برای جلوگیری از برخی بیماری ها
زمانی که تحریک سیستم ایمنی به وسیله واکسن انجام میگیرد، سلولهای تولید کننده آنتی بادی به نام سلول ها یا لنفوسیتهای B به صورت فعال باقی میمانند و آماده پاسخ دهی به عوامل بیماریزایی هستند که مجددا وارد بدن شوند.
یک واکسن گاهی ممکن است در بدن با تولید آنتی بادی یا لنفوسیتهای به دست آمده از بدن سایر جانوران مانند انسان، «ایمنی غیرفعال» (Passive Immunity) ایجاد کنند.

تصویر2. تصویر میکروسکوپی لنفوسیت B
واکسنها اغلب به صورت تزریقی مصرف میشوند، اما برخی از آنها نیز از طریق دهان یا بینی به بدن وارد میشوند. واکسنها برای انجام عملکرد خود از سطوح مخاطی مانند مسیرهای بینی و لوله گوارش استفاده میکنند، به نظر میرسد، در این حالت پاسخ آنتی بادی بزرگتر است و احتمالا این مسیرها به عنوان موثرترین راههای عملکرد واکسن عمل میکنند.
اولین واکسنها
اولین واکسن توسط فیزیولوژیست انگلیسی به نام «ادوارد جنر» (Edward Jenner) به جهان معرفی شد. جنر در سال ۱۷۹۶ از ویروس آبله گاوی (Cowpox Virus) برای ایجاد ایمنی و محافظت در برابر بیماری آبله در انسان استفاده کرد (این دو ویروس ارتباط نزدیکی دارند). قبل از انجام این فرایند، اصول واکسیناسیون توسط یک فیزیولوژیست آسیایی به کار گرفته میشد، این دانشمند برای واکسینه کردن کودکان از پوستههای خشک شده زخمهای افراد مبتلا به آبله را برای ایجاد ایمنی علیه بیماری به کار میگرفت. با این روش در برخی از کودکان ایمنی نسبت به بیماری ایجاد شد و در برخی دیگر بیماری ظاهر شد. کارهایی که ادوارد جنر انجام داد، مشابه این کار اما ایمنتر بود و در کودکان نسبت به بیماری آبله ایمنی ایجاد کرد.

تصویر3. ادوارد جنر و اولین واکسن جهان
جنر از این واقعیت استفاده کرد که در برخی موارد ایمنی بدن نسبت به یک ویروس، بدن را در برابر سایر بیماریهای ویروسی محافظت میکند.
در سال ۱۸۸۱ لوئیز پاستورمیکروبیولوژیست فرانسوی ثابت کرد که ایمنی در برابر «سیاه زخم» با تزریق شکل ضعیف شدهای از باکتری باسیلوس (عامل سیاه زخم) در گوسفند به وجود میآید. چهار سال بعد او مشابه همین سوسپانسیون را علیه بیماری هاری تهیه کرد که نسبت به این بیماری ایمنی ایجاد میکرد.
تصویر 4. تصویر میکروسکوپی Bacillus anthracis (عامل سیاه زخم )
انواع واکسن
همانطور که بيان شد جهت القا ايمنی نيازمند به آنتی ژن هستيم. آنتی ژن مورد استفاده در توليد واکسن بسيار متنوع است . در بيشتر موارد خود باکتری در واکسن وجود دارد که در چنين واکسنهايی فرم زنده از مرده ايمنی بهتری را القا می نمايد. استثناء اين قانون ، در خصوص بيماری هايی است که عامل آن سم بوده ، که در اين صورت از خود سم به شکل ضعيف شده استفاده می شود. يادآور می شوم که آنتی ژن علاوه بر مصونيت قابليت القا تولارانس را هم داراست. بنابراين اين امکان وجود دارد که تجويز فرم صحيح فراورده آنتی ژنی بتواند خودايمنی، آلرژی و دفع بافت را کنترل نمايد . چنين فراورده هايی را “vaccines Negative “می نامند.
الف – واکسنهای حاوی فرم زنده عامل بيماری زا (vaccines Live)
واکسنهای زنده به دو شکل طبيعی Natural و تضعيف شده Attenuated توليد می شوند:
الف-1- Natural live vaccines
به جز خود ويروس آبله گاوی Vaccinia هيچ نوع واکسن زنده ديگری در حال حاضر به شکل استاندارد وجود ندارد.
هرچند که برای بيماری سل يک نوع واکسن آزمايشی مطرح شده است. در ايران و روسيه ، از قديم با استفاده از گرد زخم و تلقيح آن ، فرد را در برابر عفونت حاصل از ليشمانيا محافظت می کردند که در واقع نوعی واکسن زنده محسوب می گردد.
تصویر5. مکانیسم تولید واکسن آبله گاوی
الف-2- Attenuated live vaccines
استراتژی ترجيحی در توليد واکسن، تضعيف عامل بيماری به روش های مختلف است . به واقع با اين روش قدرت بيماری زايی (Virulence) عامل بيماری کاهش . می يابد اولين نمونه موفق آن کشت 13 ساله عامل بيماری سل ( M.bovis) توسط Guerin & Calmette بود , آنچه که امروزه به عنوان BCG شناخته می شود و تا حدودی عليه بيماری سل ايجاد حفاظت می نمايد.
نمونه های ديگر تضعيف عامل بيماری کشت ويروس تب زرد ، پوليو ، سرخک ، سرخجه در موش و يا تخم مرغ جنين دار است. به واقع هر نوع تغيير در شرايط کشت عامل پاتوژن و ايجاد شرايط متفاوت ، موجب تغييراتی در عامل بيماری زا می شود که با آزمايش ميزان قدرت آنتی ژنيک از يک طرف و ميزان بيماری زايی گونه تضعيف شده ، شناسايی می گردد. هر چند که واکسن های زنده ضعيف شده مزايای بسياری دارند ليکن امکان موتاسيون در عامل پاتوژن وجود دارد. گاهی در مواردی ممکن است خاصيت خود را از دست داده و يا مجددا همانند فرم وحشی ارگانيسم
بيماری شديد ايجاد نمايد که مثالی دراين مورد واکسن فلج اطفال سابين است.
تصویر6. تصویر میکروسکوپی mycobacterium bovis
ب- واکسن های حاوی فرم کشته شده عامل بيماری زا (Killed vaccines)
به دو نوع ويروسی و باکتريال تقسيم می شوند. به لحاظ اثر بخشی می توان آنها را به چهار گروه تقسيم نمود:
1- بسيار موثر مثل واکسن هاری و فلج Salk ، هپاتيت آ
2- موثر مثل تيفوئيد و انفلونزا
3- کم اثر مثل طاعون ، وبا ( به دليل اثر بخشی پايين استفاده از آن قدغن شد )
4- سميت فوق العاده مثل سياه سرفه

تصویر7. پیشگیری از قرار گرفتن در معرض هاری
ج- توکسين های غير فعال شده(Inactivated Toxines)
موفق ترين واکسن باکتريال ، واکسن عليه کزاز و ديفتری می باشد که اگزوتوکسين توليد شده توسط باکتری به کمک فرمالين غير فعال می شود. در خصوص واکسن کزاز و ديفتری که اگزوتوکسين به کمک فرمالدئيد غير فعال می شود گزارشاتی وجود دارد که فرمالدئيد موجب پيوند عرضی پپتيدهای گاوی موجود در محيط کشت شده و آنتی ژن اضافه به همراه توکسوئيد به فرد تزريق می گردد. در جهت رفع اين نقيصه تلاش شده که به کمک مهندسی ژنتيک مولکولی طراحی شود که با تغيير يک اسيد آمينه اثر سمی نداشته ولی اثر محافظتی داشته باشد . تاکنون واکسنی عليه اگزوتوکسين های استرپتوکوک و استافيلوکوک و يا اندوتوکسين های باکتريال مثل ليپو ساکاريد وجود ندارد .
کاربرد ديگر واکسن کزاز ، استفاده از آن به ” عنوان حامل ” است. از آنجا که اکثر مردم در برابر کزاز واکسينه شده اند ، در صورت همراهی آن با عوامل غير ايمونولوژيک نظير پنوموکوک و يا مالاريا می توان ايمنی اکتسابی و سلولهای T را تحريک نمود. به واقع کپسول پنوموکوک که از جنس پلی ساکاريد است يک آنتی ژن غير وابسته به تيموس است که به مولکول MHC متصل نمی شود که در صورت همراهی آن با حامل اين مسئله رفع می گردد.
د- آنتی ژنهای سطحی و اجزا پيکره ای(Subcellular fragments &surface Ag)
در خصوص باکتری های کپسول دار نظير پنوموکوک , مننگوکوک و هموفيلوس انفلونزا پلی ساکاريد های پوشش استفاده می شود. همچنين از پوشش آنتی ژنی ويروس هپاتيت B به عنوان واکسن استفاده شده است. اين چنين واکسن هايی از لحاظ سلامت و اثر بخشی بسيار مناسب می باشند و عموما پاسخ سلولهای B و توليد آنتی بادی راتحريک می کنند.
ه – واکسنهای جديد(Future vaccines)
زمانی که مشخص گرديد بخش های کوچکی از يک ارگانيسم می توانند مصونيت زا باشند، تلاش در جهت توليد صناعی اين اجزا آغاز شد. بديهی است که در سطح يک ميکروارگانيسم هزاران مولکول خارجی برای شناسايی سيستم ايمنی وجود دارد، اما سيستم ايمنی نسبت به بسياری از آنها پاسخی نداده و اين مولکول ها نقشی در القای حفاظت در فرد ندارند. لذا در طراحی واکسن تلاش می شود که مولکول های اصلی شناسايی، جداسازی و تخليص شوند؛ تا واکسن توليدی اثر حفاظتی داشته باشد . در حال حاضر تحقيقات گسترده ای در حال انجام است که واکسن هايی طراحی شوند تا از يک طرف سيستم ايمنی را در شرايطی نظير بيماری های راجعه و مزمن تقويت نمايد و از طرف ديگر کيفيت واکسن های موجود را ارتقا دهند.
- يکی از اين روشهای توليد واکسنهای جديد ، کلون کردن ژن مورد نظر در يک وکتور مناسب است. نمونه از اين نوع واکسن هپاتيت B می باشد که آنتی ژن سطحی ويروس را در مخمر تکثير و سپس جدا نمودند . پروتئين سطحی پس ازSelf- assembling ذرات Virion- Like بيست و دو نانومتری توليد می کنند که می تواند ايمونوژن باشد .
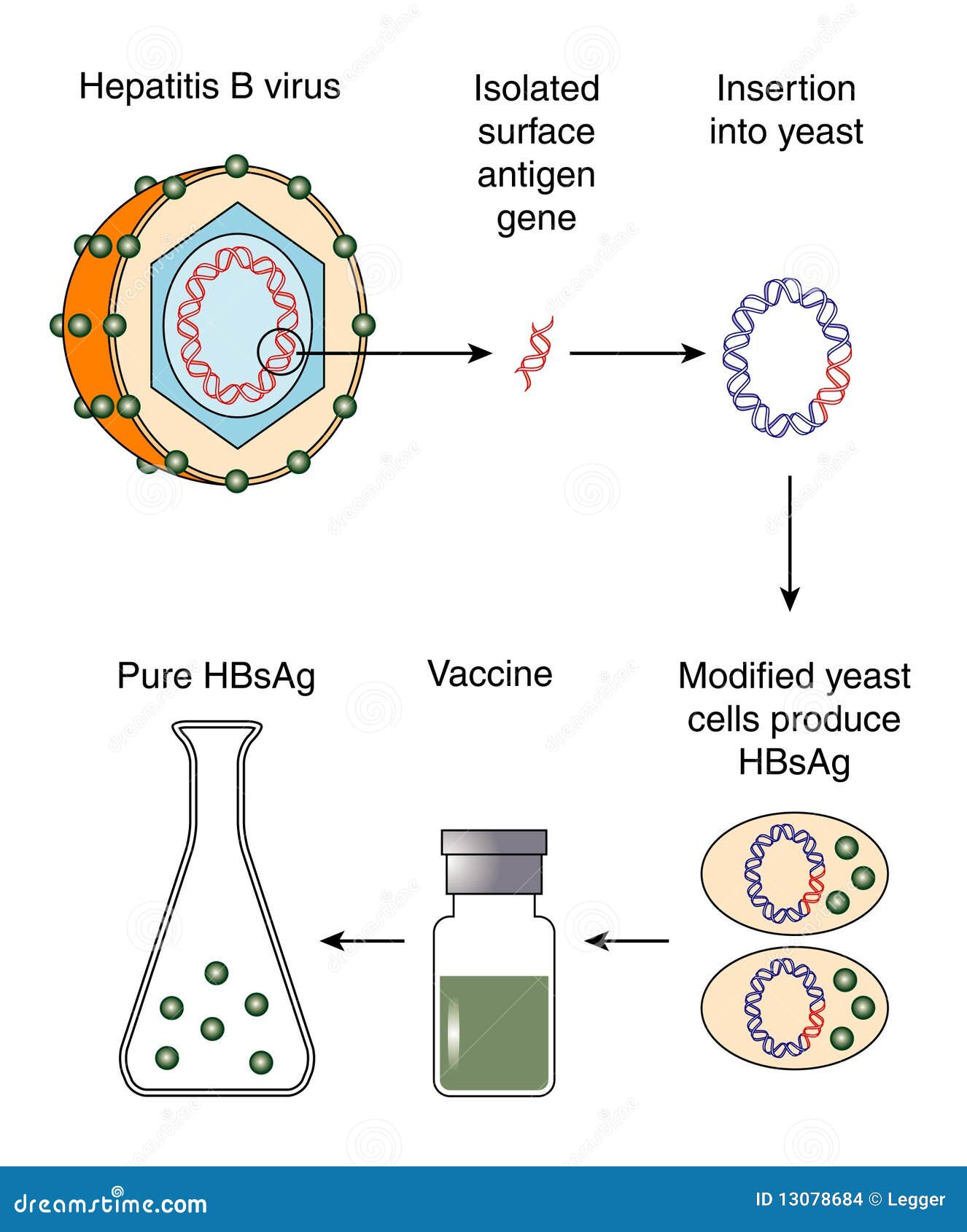
تصویر8. مکانیسم تولید واکسن هپاتیت B
- Vectored vaccines: روش ديگرتوليد واکسن بيان ژن مورد نظر در يک وکتور مناسب نظير ويروس واکسينيا می باشد. علاوه بر ويروس واکسينيا که عنوان اسب تروجان شناخته می شود از ساير ويروسها نظير ويروس avipox , آدنوويروس ، پوليوويروس ، ويروس هرپس و باکتري هايی نظير سالمونلا ، شيگلا و BCG به عنوان وکتور استفاده شده است. هر چند که از معرفی اين روش حدود 20 سال می گذارد ليکن این شيوه استفاده چندانی در جهت توليد واکسن نداشته است که بخشی از آن به علت نتايج نامشخص اين گونه فراورده ها در آزمايشات بالينی بوده است .
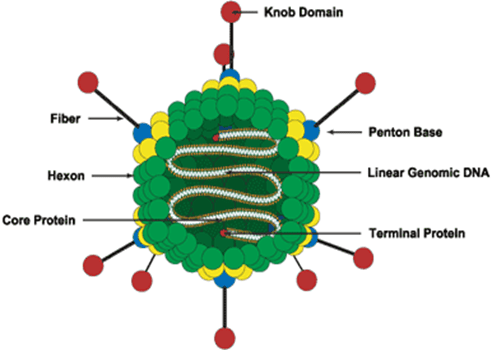
تصویر 9. ساختار آدنو ویروس
- DNA vaccines یا Nucleic acid vaccines: تزريق مستقيم DNA که با يک پروموتر مناسب مزدوج شده است روش ديگری در ايجاد ايمنی می باشد. در اين روش هم ايمنی همورال و هم ايمنی سلولی فعال می گردد . واکسن DNA تزريق شده در عضله از طريق عرضه به وسيله APC در همراهی با مولکول I-HLA می تواند سلول های CTL را فعال . نمايد از مزايا واکسن های DNA ، پايداری آنهاست. تغييرات آنها از يک بچ تا بچ ديگر فوق العاده ناچيز است. علاوه بر اين اين نوع واکسن ها ارزان بوده و مقدار DNA مورد نياز در حد نانوگرم می باشد. از نکاتی که هنوز در خصوص واکسن های DNA مورد مباحثه است موضوع کارسينوژن، موتاژن بودن و يا ايجاد خود ايمنی است. موضوع ديگر اين است که مقادير کم آنتی ژن که در طول زمان طولانی در بدن فرد عرضه می شود امکان ايجاد تولارنس را دارد.
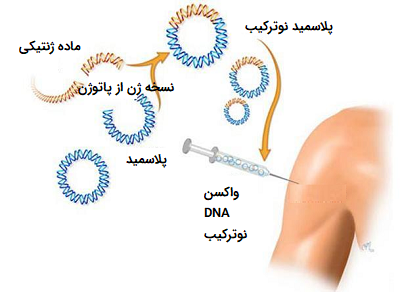
تصویر10. واکسن DNA نوترکیب
- واکسن های ايديوتايپ: ايده توليد اين نوع واکسن بر اساس تکنولوژی توليد آنتی بادی مونوکلونال (mAb) جهت ساخت مقادير فراوانی از anti idiotype عليه ناحيه متغير يک آنتی بادی که مشخصا ارزش محافظتی دارد پايه گذاری شده است. آنتی ايديوتايپ مشابه آنتی ژن اصلی است چرا که شکل سه بعدی آن مشابه آنتی ژن است.
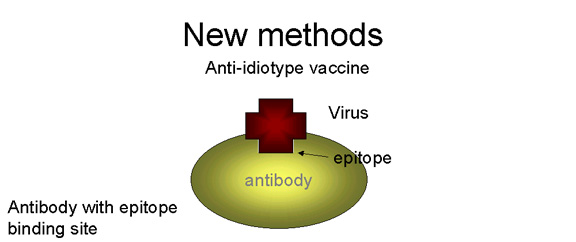
تصویر11. واکسن ایدیوتایپ
مقايسه واکسن های زنده و کشته شده
همانطورکه پيشتر اشاره شد واکسن های زنده پاسخ بهتری ايجاد می کنند. دلايل برتری واکسن های زنده
عبارتست از:
- واکسنهای زنده حاوی تمامی اجزا ساختاری اعم از آنتی ژنيک و يا غير آنتی ژنيک می باشند.
- همانند خود عامل پاتوژن عمل کرده و جايگاه اصلی پاتوژن را در بدن اشغال نموده و موجب ايجاد پاسخ ايمنی مشابه عامل پاتوژن می گردند .
- واکسن های زنده با يک بار استفاده سطح ايمنی مناسبی را ايجاد نموده که تا مدتها باقی می ماند . به دليل قدرت تکثير در بدن ميزبان ، مقدار آنتی ژن افزايش می يِابد در صورتی که در واکسنهای حاوی ارگانيسم کشته شده چون تکثير وجود ندارد لذا نيازمند تزريق يادآور می باشيم.
- در برابر واکسنهای زنده IgG و IgA توليد می شود در صورتی که در برابر واکسن کشته شده عمدتا IgG توليد می گردد .
- نياز به استفاده از مواد کمکی (آجوانت) برای واکسنهای زنده وجود ندارد.
آجوانت(Adjuvants)
آجوانت ها مواد و يا فراورده هايی هستند که توانايی افزايش پاسخ ايمنی را در همراهی با آنتی ژن دارا می باشند. آجوانت ها عموما از طريق تجمع و فعال سازی سلولهای عرضه کننده آنتی ژن ، موجب تشديد فعاليت لنفوسيت های T . می شوند به واقع آجوانت با اثرروی سلولهای عرضه کننده آنتی ژن موجب افزايش بيان مولکول های کمک تحريکی
و سايتوکاين ها . می گردد از سوی ديگرآجوانت ، مدت زمان عرضه آنتی ژن توسط سلولهای عرضه کننده آنتی ژن را افزايش می دهد.
با درک مکانيسم های تحريک لنفوسيت T و ايجاد خاطره ، تلاش در جهت يافتن آجوانت هايی که پاسخ ايمنی سلولی را تحريک نمايند آغاز شد. هر چند که بسياری از آنها تنها در آزمايشگاهای تحقيقاتی به کار می روند، ليکن نمونه ای از آنها، آجوانت کامل فروند می باشد که باعث القا DTH و توليد آنتی بادی می گردد . در صورتيکه آجوانت ناقص فروند توليد آنتی بادی را موجب می گردد. از ديگر آجوانتها می توان به آلوم اشاره کرد که استفاده ازآن با آنتی ژن موجب ايجاد ساختارهای ژل مانند غير محلول می شѧود. آلѧوم موجب تحريک توليد آنتی بادی ( حتی IgE ) می شود، اما اثرات آن بر پاسخ DTH و يا +CD8 کم است. امروزه از آلوم به صورت گسترده ای در توليد توکسوئيد ديفتری و کزازاستفاده می شود.
ليپوزوم ها و کمپلکس های تحريک کننده ايمنی نمونه های ديگری از آجوانت ها هستند که آنتی ژن را در خود حبس نموده و به سلولهای APC تحويل می دهند . محصولات باکتريال نظير ديواره سلول مايکوباکتريوم , اندوتوکسين و غيره احتمالا با تحريک توليد سايتوکين مناسب عمل می نمايند. سايتوکين ها خود نيز می توانند همانند يک آجوانت موثر عمل نمايند به خصوص هنگامی که با يک آنتی ژن همراه شوند.اين ترکيبات به خصوص در افراد دچار ضعف سيستم ايمنی می توانند مفيد واقع شوند.
واکسن های موجود(Current vaccines)
جدول واکسيناسيون و برنامه ريزی آن در کشورهای مختلف تا حدودی متفاوت است . در بدو تولد تا دو ماه معمولا به علت وجود آنتی بادهای انتقال يافته مادراز طريق جفت به نوزاد واکسن تزريق نمی گردد ( مصونيت پاسيو). در کشور ما به علت عدم واکسيناسيون گسترده و خطر ابتلای بالای بيماريهايی نظير هپاتيت B , و سل در بدو تولد اين دو واکسن تجويز می شود . واکسن سه گانه ( ديفتری, کزاز و سياه سرفه) وبه صورت سه نوبت اصلی هر دو ماه يک تزريق و دو نوبت يادآور (15 ماهگی و4 تا 6 سالگی با حذف سياه سرفه) عضلانی تزريق می شود. واکسن خوراکی
فلج اطفال ( سابين) یبه صورت تر ( والان حاوی هر سه نوع ويروس به صورت ضعيف شده) به لحاظ جدول زمانی همانند واکسن سه گانه می باشد . در 12 ماهگی واکسن سرخک ( حاوی ويروس ضعيف شده) به تنهايی و يا به همراه واکسن اوريون و واکسن سرخجه تزريق می شود. از آنجا که در صورت ابتلا به ويروس سرخجه خطر سقط جنين در سه ماهه اول بارداری وجود دارد توصيه می شود دختران قبل از سن ازدواج مجددا عليه آن واکسينه شوند.
| ردیف | سن | نوع واکسن |
| 1 | بدو تولد | BCG ، هپاتیت B1 |
| 2 | دو ماهگی | سه گانه , 1 پوليوی خوراکی , 1 هپاتيت B2 |
| 3 | چهارماهگی | سه گانه 2 ، پوليوی خوراکی 2 |
| 4 | شش ماهگی | سه گانه 3 ، پوليوی خوراکی 3 ، هپاتيت B3 |
| 5 | دوازده ماهگی | سرخک, سرخجه و اوريون (نوبت اول) |
| 6 | هجده ماهگی | سه گانه ( يادآور يک) پوليوی خوراکی ( يادآور يک) |
| 7 |
ورود به مدرسه |
سه گانه ( يادآور دو ) ، پوليوی خوراکی (يادآوردو ) MMR(نوبت دوم) |
| 8 | 14 تا 16 سالگی | دو گانه ويژه بزرگسالان |
به نظر می رسد با تلاش جهانی چهار بيماری فلج اطفال , سرخک , سرخجه و اوريون تا اوايل قرن 21 ريشه کن خواهد شد ليکن برای برخی ديگر از بيماری ها مشکلاتی وجود دارد:
- وضعيت ميزبان: حذف هپاتيت B کار دشواری است زيرا در مکانهايی نظير شرق دور انتقال مستقيم مادر به نوزاد وجود دارد ( فرم حامل).
- اثربخشی متفاوت: اثربخشی واکسن BCG از يک کشور تا کشور ديگر متفاوت است. سل به خصوص در نقاطی که مسئله AIDS هم وجود دارد, در حال افزايش است. مثال ديگر در اين مورد واکسن سياه سرفه است که تنها % 70 اثربخشی دارد .
- عوارض جانبی: عارضه جانبی واکسن سياه سرفه تا حدی است که در بسياری از کشورها استفاده نمی شود .
- وجود شکل زنده و مخازن حيوانی: باسيل کزاز همواره در محيط وجود دارد و تب زرد مخزن حيوانی دارد .
- هوشياری در خصوص بيماری هايی که به نظر در حال ناپديد شدن هستند اين امرموجب کاهش مخازن عفونت و وقوع بيماری در سنين بالاتر می شود. مثال هايی از آن بروز سرخک و سرخجه در سنين بالاتر و عواقب شديدتر بيماری است.
- در برخی موارد در لحظه همه گيری يک بيماری ممکن است واکسن مورد نظر وجود دن اشته باشد. نمونه آشکارآن بيماری انفلونزا می باشد. آنتی ژنهای هم آگلوتنين و نورآمينيدازدراين ويروس همواره در حال تغيير هستند ودر چنين شرايطی بيماری به وسيله يک سويه جديد ايجاد شده که واکسن بر له آن هنوزتوليد نشده است.
برخی از واکسن ها مثل هپاتيت B ،تب زرد و هاری برای شرايط خاص نظير مسافرت به منطقه آلوده، پرسنل بهداشتی و افراد مسن به کار می روند. در حال حاضر برای بسياری از بيماری ها نظير بيماريهای انگلی و عفونتهای کرمی واکسنی وجود نداشته و تلاشهايی گسترده ای در جهت توليد واکسن عليه آنها درحال انجام است .
فواید استفاده از واکسن
علاوه بر توسعه سلولهای B خاطره که قادر به ایجاد پاسخ ایمنی ثانویه در هنگام قرار گرفتن مجدد در معرض پاتوژنی که واکسن آن پیشتر دریافت شده، هستند، واکسیناسیون در سطح جمعیت نیز مفید است. هنگامی که تعداد کافی از افراد در یک جمعیت در برابر یک بیماری مصون هستند، مانند زمانی که بخش بزرگی از جمعیت واکسینه میشوند، «ایمنی جمعی» (Herd Immunity) حاصل میشود. این بدان معناست که اگر اختلاط تصادفی افراد در بین جمعیت وجود داشته باشد، نمیتوان پاتوژن را در کل جمعیت گسترش داد. ایمنی جمعی با شکستن زنجیره انتقال عفونت یا با کاهش احتمال انتقال بیماری به افراد مستعد در تماس با شخصی که عفونی است، از شیوع گسترده بیماری جلوگیری میکند.
ایمنی جمعی برای افرادی که شخصاً از ابتلا به این بیماری در امان نیستند، محافظت میکند. به عنوان مثال، افرادی که به دلیل سن و شرایط پزشکی خود نمیتوانند واکسن دریافت کنند یا افرادی که واکسن دریافت کردهاند اما همچنان مستعد ابتلا به بیماری هستند، با وجود ایمنی جمعی از خطر ابتلا به بیماری در امان میمانند. ایمنی جمعی نقش مهمی در ریشه کن کردن موفقیت آمیز بیماری آبله در سراسر جهان داشته است، علاوه بر این، واکسیناسیون در جلوگیری از شیوع بیماریهایی مانند فلج اطفال و سرخک نقش بسزایی دارد.
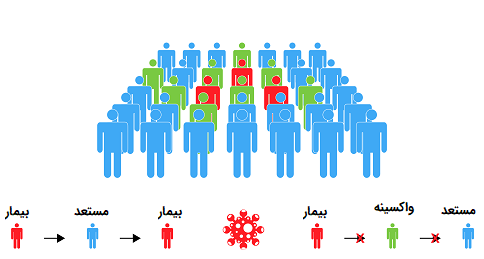
تصویر 12. نحوه عملکرد ایمنی جمعی و جلوگیری از شیوع بیماری
عوارض جانبی واکسن
واکسیناسیون علاوه بر مزایایی که به همراه دارد، ممکن است واکنشهایی را نیز در بدن ایجاد کند. هر چند عوارض جانبی ناشی از واکسن معمولاً بسیار نادر و بسیار خفیف هستند. شایعترین واکنشها در مورد واکسنها شامل قرمزی و درد در اطراف محل واکسیناسیون است. واکنشهای شدیدتر مانند استفراغ، تب بالا، تشنج، آسیب مغزی یا مرگ در مورد برخی از واکسنها ممکن است، رخ دهد. چنین واکنشهایی بسیار نادر هستند، به طوری که این عوارض و خطرات ممکن است در ۱ نفر از هر یک میلیون نفری که مورد واکسیناسیون قرار میگیرند، اتفاق بیفتد. واکنشهای شدید ناشی از واکسیناسیون فقط روی برخی از جمعیتهای خاصی ممکن است تأثیر بگذارد، مانند افرادی که سیستم ایمنی بدن آنها در اثر بیماری زمینهای (مثلاً HIV / AIDS) به خطر میافتد یا تحت شیمی درمانی قرار میگیرند.
برخی از دانشمندان با توجه به عوارض جانبی واکسنها ادعا میکنند که آنها مسئول به وجود آمدن برخی از شرایط نامطلوب سلامتی، به ویژه «اوتیسم» (Autism)، اختلالات گفتاری و بیماری التهابی روده هستند. برخی از این ادعاها بر روی «تیومرسال» (Thimerosal)، یک ترکیب حاوی جیوه که به عنوان ماده نگهدارنده در واکسنها استفاده میشود، متمرکز شده است. برخی از دانشمندان معتقد هستند که اوتیسم نوعی مسمومیت با جیوه است که به طور خاص توسط تیومرسال که در واکسنهای دوران کودکی وجود دارد، ایجاد میشود.
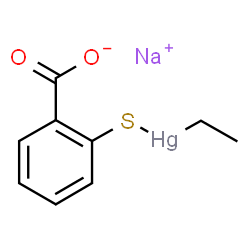
تصویر13. ساختمان شیمیایی تیومرسال
این ادعاها تاکنون رد شدهاند و هیچ گونه اعتباری ندارند، با این وجود، اطلاعات نادرست و ترس ناشی از ادعاهای دروغین در مورد ارتباط بین اوتیسم و واکسنها، تأثیر معنی داری بر درک افراد درباره ایمنی واکسنها داشته است. علاوه بر این، بیشتر افراد در کشورهایی که واکسیناسیون در آنها به صورت گسترده انجام میگیرد، هرگز به طور مشخصی بیماری قابل پیشگیری از واکسن را تجربه نکردهاند. بنابراین، تمرکز نگرانی برخی از افراد از اثرات منفی بیماریهای قابل پیشگیری با واکسن، به سمت اثرات منفی احتمالی خود واکسنها منحرف شده است.
نارضایتی در مورد بیماریهای قابل پیشگیری با واکسن، همراه با نگرانی درباره اثر واکسیناسیون، منجر به کاهش سطح پوشش واکسیناسیون در برخی مناطق جهان شده است. در نتیجه، افراد نه تنها مستعد ابتلا به بیماریهای قابل پیشگیری با واکسن نیستند، بلکه در سطح جمعیت نیز میزان واکسیناسیون به اندازهای پایین آمد که باعث از بین رفتن ایمنی جمعی شود، از این طریق امکان شیوع گسترده بیماری فراهم میشود.
موارد منع مصرف
واکسيناسيون در موارد ذيل منع شده است:
– در صورت امکان از هرگونه واکسيناسيون در شرايط بارداری بايستی خوداری کرد. در موارد ضروری واکسن کزاز را می توان در ماه ششم و هفتم استفاده نمود .
– در افراد دچار نقص ايمنی مثل انواع لوسمی و يا سل پيشرفته
– در بيمارانی که داروهای مهار کننده سيستم ايمنی مصرف می کنند و يا تحت شيمی درمانی و يا پرتو درمانی قرار گرفتند .
– دو ماه پس از انتقال خون يا پلاسما و سه ماه پس از تزريق گاما گلوبولين


